지난해 5월 품목허가가 취소된 코오롱생명과학의 골관절염 유전자 치료제 '인보사케이주'(이하 인보사)와 관련해 암(종양) 발생이 보고된 사례가 총 32건으로 나타났다.
2건은 추적보고 등을 통해 암이 아닌 것으로 최종 확인돼 '평가 불필요' 조처됐다.
19건은 현재까지 조사와 연구 결과를 종합할 때 약과의 인과관계를 인정한 근거는 없지만, 종양의 발생원인(가족력, 과거 질병, 생활습관, 특정 화학물질 노출, 직업, 환경 등)이 다양하고, 발생 양상이 복잡하며, 매년 병원 방문 검사 등이 이뤄지고 있는 점을 고려해 '추적관찰이 필요'한 것으로 결론이 났다. 나머지 4건은 검토 중이다.
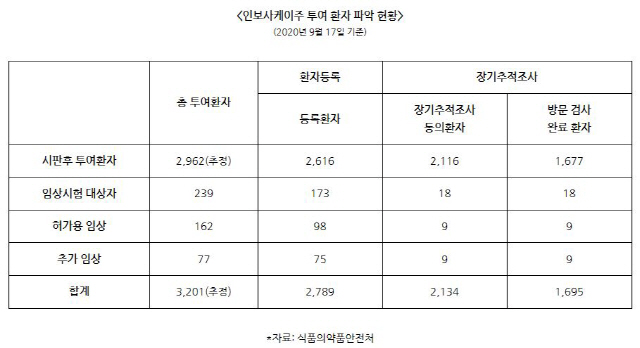
이 가운데 추적 대상으로 등록된 환자 수는 2789명(87.1%)이다. 장기 추적조사에 동의한 환자는 2134명(66.7%)이며 방문 검사를 완료한 환자 수는 1695명(53%)이다.
정 의원은 "인보사의 총 투여환자 파악이 아직 되지 않고 있으며, 부작용으로 암 발생 사례가 보고되고 있지만 아직 정확히 그 원인이 규명되지 않고 있다"며 "투여환자 파악과 지속적인 장기 추적조사가 반드시 이뤄져야 하며 바이오의약품 안전 및 품질 확보를 위한 전주기 안전관리 체계 구축이 반드시 필요하다"고 강조했다.
한편, 골관절염 유전자치료 주사액인 인보사는 2017년 식약처의 허가를 받았지만 당시 제출한 자료에 기재된 연골세포가 아닌 종양을 유발할 가능성이 있는 신장세포로 드러나 지난해 5월 품목허가가 취소됐다. 이후 식약처는 제조사인 코오롱생명과학에 투여환자에 대해 15년간 장기추적조사를 하도록 했다.
장종호 기자 bellho@sportschosun.com
|
무료로 보는 오늘의 운세